CAR-T的前景
临床实验表明,抗CD19的嵌合性抗原受体(CAR)T细胞疗法,对难以治愈的白血病病人具惊人的疗效;在39例急性白血病病人中, 92%的病人具有的完全缓解功效。这些变革性的结果,打破了抗癌战争的平衡性:如果这些缓解具持久性,那么该技术则提高了晚期癌症病人治愈的可能性。
这些相关数据,激发了投资者在生物技术板块和生物技术领域投资的特别兴趣。创业公司则提高了私人资本的数额,并加大了随后IPOs中的对应金额,并获取了令人羡慕的公共市场估值。尽管该领域迅速地发展成熟,一切仍在持续发生变化当中;重要投资的标准,如严格的清晰的IP,却在一定程度已经被遗忘。
大型制药公司也开始进入该领域; 2012年8月,诺华和宾夕法尼亚大学结成联盟,这发生在宾夕法尼亚大学获得CD19构建体的初步临床数据之后。诺华同意在宾大的费城校区投资两千万美元建设高级细胞治疗中心。这一过程,对一向高度关注小分子和单克隆导向疗法的诺华来说,是一个极大的冒险。诺华将关注投向自体细胞治疗,这截然不同于其传统的交易决策风格。通过自身的研究和持续的交易决策,该公司寻求获取该领域富有野心的领导地位。
2013年3月,Celgene和Bluebird生物公司宣布了一项肿瘤学基因疗法的全球策略性合作,其关注点在于CAR-T技术。协议的财务条款包括一项预先的支付,以及每个产品在潜在费用、临床和重大变革上的高达22500万美元的费用支出。
2014年6月,辉瑞和Cellectis公司开始一项全球性肿瘤免疫疗法合作,进行CAR-T技术的开发。辉瑞获得Cellectis公司的同种异体的方法,辉瑞可选取15个靶标。Cellectis公司获得预付8000万美元资金,以及高达18500万美元的资金融资。
2015年1月,安进和Kite公司宣布了一项在癌症免疫治疗上的战略性合作,旨在综合利用安进的肿瘤靶标和Kite的CAR-T平台,从而开发新的治疗方法。Kite获得安进预付的8000万美元资金,以及每个项目高达52500万美元的资金融资。
2015年6月,Celgene公司加强了在该领域的投入,宣布和Juno公司(尽管是在明显缩小和Bluebird的合作之后)长达十年的合作。Celgene公司,获取了在北美之外对Juno的项目进行商业化的选择,并进行了十亿美元的投资。
但是,该技术若达到顶尖水平,仍存在很大问题,至少还需解决本领域两个主要的问题。 第一,这些技术能以合理的费用商业化吗?(CAR-T技术采用自体细胞,这对物流上是一个挑战);
第二,除了白血病,该技术可以被用于癌症吗?在一系列实体瘤中获得同样实验结果的一项让人印象深刻的技术,将会成为医药历史上里程碑的事件。
关于实体瘤
尽管晚期血液瘤的治疗成功,意味着临床上的胜利,但商业上的胜利还依赖于对代表肿瘤90%的实体瘤的争战。目前仍缺乏临床数据;目前让人印象深刻的临床数据包括:
1) 通过适应免疫手段制备了NY-ESO-1特异性T细胞,并用该细胞治疗了十个滑膜肉瘤病人,治疗后缓解的比例为60%,持续时间为2到9个月。
2) 宾大组用CAR-T细胞识别间皮素治疗了十个患有胰腺导管腺癌(PDAC)的病人,间皮素是一种在PDAC细胞中过表达的抗原。通过RECIST评估,在六个病人中,有2个病人病情稳定,其中一个病人在超过4个月的时间里病情得到控制,脱离治疗。一个病人的突变18FDG在肝中的转移,处于基线水准;在治疗后的第30天,没有检测到该物质。
在获得令人鼓舞的初步功效数据后,这些结果仍不能达到可能“改变游戏”的非理性标准,这些标准是很多投资人和大制药公司期望从过继性细胞免疫疗法中所看到的。
主要的技术挑战依然存在,尤其是足够的工程T细胞对肿瘤位点的定位,从而发挥充分的疗效:毒性对疗效的比例。此外,实体瘤的微环境,或许也表明其对CAR-T细胞的不友好性;诱导抗原,也可能是限制持续存在的CAR-T细胞的疗效的因素,持续存在的CAR-T细胞本身也会产生问题。最后,在一些肿瘤疫苗研究中,通过抗原逃逸的丢失机制,出现了CAR-T细胞抵抗性疾病,这限制了CAR-T疗法缓解的持续性。如下面讨论的因素,也严重限制了这种模式的作用。
生产和物流的困难
目前,大多数的CAR-T和TCT-工程T细胞由以下繁琐的定制步骤制备:
l 通过白细胞分离法从癌症病人身上提取T细胞,这将消耗几个小时。在这过程中,病人被两个静脉管和一个血浆分离置换机器连接。这对病人来说,并不舒适,产生了一些明显的消耗;最后,大规模的自体CAR-T疗法,受血浆分离置换能力的限制。
l T细胞的激活和转导。最初的CAR-T流程,采用抗CD3抗CD28磁珠进行T细胞的激活;诺华最早开始采取行动,进行CAR-T产品试剂的排他性商业布局,增强了它在该领域独有地位。从那时开始,对磁珠的选择已经被成功应用,它也不再是一种商业障碍。尽管非病毒系统也被使用,但转导依然采用逆转录病毒载体或慢病毒载体。
l 转导T细胞的扩增,通常需要约2周多的时间,扩增是在补充细胞因子(通常为IL-2)的组织培养基中进行。
l 治疗前对T细胞的冲洗和浓缩。对于通过中心设备制备的CAR-T产品运输到远端的治疗中心,相应的深低温储藏的方法已经被开发。
l 对每一批CAR-T产品需进行QC释放实验
整个流程需在限定环境的GMP要求的条件下进行, GMP环境的维护和运行费用昂贵。通过从治疗病人身上获取最初材料(T细胞)进行CAR-T产品的制备,这对于这些CAR-T产品来说,并不需要大经济规模的投入:生产能力提高的同时,还需要相应外围部分的提高和市场的拓展。最早的生产流程基于实验室,并完全由人工操作,需要对生物安全柜和隔离区有开放的组织培养处理:这在早期阶段性临床研究是可行的,但这种方法明显不适合商业上的使用。工业级别的生产流程需要在密闭系统(零开放处理)和自动化操作中进行,主要避免复杂流程中人为因素的影响,而且或降低费用。尽管个别管理机构会在细节上严格审查完全密封系统,并可能要求复杂而昂贵的C级条件,但完全密封的系统已可以完全适用于D级清洁房间(EU cGMP分类)。目前,符合自动化生产要求的密封系统设备是Miltenyi CliniMACS Prodigy。尽管如此,也不是每个操作都可在该系统上完成(比如,和逆转录相比,该系统更适合慢病毒的转导,这取决于该系统每个步骤的详细参数,在这里不做讨论)。
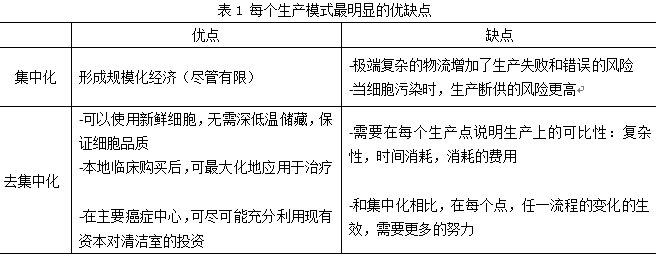
对于CAR-T生产的定位有两种考虑。一种是大公司的工业化思维——倾向于,每年通过大型集中化的设备,从成千上万的病人中处理T细胞。另一种是去集中化的模式,和当地的专业治疗中心共同生产(如大学医院,主要的癌症治疗中心)。理论上,对于每年生产不同数量的细胞,会存在一个优选的合适规模性的自动生产模型。经济规模并不存在线性的关系,比如,在一些情况下,有2两个同时进行的小模块,每一个每年都能生产500剂量;而另一个为中型模块,其每年能生产1000剂量;前者的效率却比后者更高。这些考虑对决定采用何种模式发挥重要作用(尤其是去集中化的程度,如在美国,什么是最优的选址数目?20, 50, 还是100?)。
价格,赔偿和市场进入
不论采用哪一种模式,对于每一个病人,自体CAR-T细胞治疗的生产费用,都可能在25-35,000美元,即使在后期最大的流程效率被充分发挥,也是如此。需要注意的是,这仅仅是治疗的生产费用,事实上,治疗过程中,还会产生一些额外的费用(目前,CAR-T的治疗前,多数的操作还需要淋巴细胞删除,对于病人这是一个昂贵耗时的过程)、CAR-T的治疗费用和随后的护理费用(明显地,严重副作用的监控和治疗所需的材料,如CAR-T引起的细胞风暴)。因此,整个治疗费用和那些进行自身骨髓移植并加上CAR-T治疗的费用一样高。
诺华和宾夕法尼亚大学交易引发的直接结果是,据财务分析师估测,每个病人的CAR-T的治疗费用将定价在250,000美元,甚至更高。因为目前尚无CAR-T产品被用于市场,将来的定价依然是推测性的,但是很多分析师对价格范围进行了基本的预估,每个病人在150,000 美元到300,000美元之间。即使在该范围的低价格区,依然高于现有新抗癌药的年治疗费用。在面临癌症药物公平价格的争论日益增多的时候,这些价格区间,咋看起来似乎是飞升一样的价格。伶牙俐齿的临床医生也不能接受过度的药物标价(2012年10月开始,在Memorial Sloan-Ketterin癌症中心的医师在纽约时报宣称,他们的医院不再使用阿柏西普,一种治疗结直肠癌的靶向VEGF的新药),健康技术评估(HTA)也日益限制高价治疗的应用。一项最近的研究,评估了1995到2013年间获批的58种抗癌药物的数据信息,发现起始价格每年增长10%,大约8,500美元,该价格都根据通货膨胀和药物生存获益进行了调整。因此,在2004年,治疗晚期结直肠癌的贝伐单抗药物发行的时候,它的价格为每个治疗周期50,000美元,并且在病人五个月生存期里逐渐增长。几年后,在2011年,易普利姆玛药物获批用于黑素瘤治疗,其价格也是在病人四个月生存期里逐渐增长,起始价格为每个治疗周期120,000美元。在预算已经受限的医疗保健环境下,这种趋势已经不可逆转地持续存在。
因此,关键问题是:投资人是否在这些水平上进行CAR-T治疗的投资?这对全盘考虑这个技术的商业前景至关重要。简洁的答案就是,它取决于这个新治疗方式能取得的临床效果的水平。在多数乐观(很可能不现实的)的情况下,CAR-T治疗应该包括长期的缓解,假定为五到十年。用英国的每质量调整生命年30,000英镑 (47,000美元)的NICE标准,这需最大可回收价格为235-470,000英镑。考虑到癌症病人不完美的生存质量,这个数目还要向下调整,但CAR-T的治疗仍需大约118-235,000美元。考虑到NICE方法是药物主流市场上最严谨的方法,英国药物价格可能比美国(主要市场)和其他国家更低,很可能HTA能接受的CAR-T疗法价格要比这个价格段要高,因此会和现有分析项目相一致。但是,任何低于五年缓解稳定的效果,都有可能降低这些计算的价格段。这或许就是一种过度复杂的说法:CAR-T治疗只会在它们临床有效的情况下获得资金;但严格的结论是,商业生存的标准要远高于不复杂的现代肿瘤药物如单克隆抗体的标准。在现有的针对病人的自体疗法中,除非CAR-T疗法对大批治疗的病人有长期的缓解效果,商业成功的机会仍然是低的。
驱动商业成功的新技术
刚开始出现的大量的技术都注重提高过继性细胞免疫治疗的临床和商业前景。这些技术里的一些技术目的在于增强CAR-T细胞的效率,例如,增强融合细胞对肿瘤细胞的定位,较弱的定位被认为是实体瘤中CAR-T细胞效率明显低于循环肿瘤的主要原因。也有一些方法用于增强CAR-T细胞的耐用性,而不只是循环过程中的耐用性程度,还用于增强活性的表型。另外,一些研究人员在评估一些防御肿瘤机制躲避或瘫痪免疫系统的方法;这些“反导弹的导弹”在增强CAR-T功效上也许还要走很长的路。
在关注CAR-T疗法的安全性上也有一系列的方法。有一些证据表明,如果不是直接相关的话,细胞因子释放综合征和临床效率是有关的,或许存在一些方法能减缓综合征的严重性,虽然还没有太大的消除效率。在重症监护病房, CAR-T疗法副作用的减少,对病人是有益的;对治疗中心来说也是实用的;对投资者来说,也更具有吸引力。
提高细胞免疫治疗最基础的方法也许将是,将定制的病人特异性的流程,变革为可大批量生产的产品;这将减少治疗(产品应该是可从存货里获取的)过程的诱导次数,获得更低的生产成本(考虑价格的降低并不过分牺牲利益率),而且符合药物工业产品分布的模式。要达到这个目标,第一步就是采用健康捐赠人的同种异体的T细胞,比如用基因编辑消除内源性T细胞受体,因此避免受体的急性排斥,而且捐赠人可以提供足够的细胞治疗各种病人。最终,我们将看到这种方法将扩展到对T细胞的固定,T细胞可在工业规模上大范围培养,消除了对T细胞捐赠人的需要;大规模生产的能持续缓解的同种异体的T细胞,虽然是一个梦想,但至少已经在一些优质研究组的目标当中,因此也有一定实现的可能性。

